셀트리온, 강원도 산불 피해 지원에 1억원 기탁
2023-04-26
셀트리온은 성인 환자에게 쓰는 램시마SC를 궤양성 대장염 소아 환자와 크론병 소아 환자에게도 사용할 수 있는지 평가하기 위해 임상을 신청했다. 램시마SC는 정맥주사(IV) 제형으로 개발된 인플릭시맙 성분 의약품을 자가 주사가 가능한 피하주사(SC) 제형으로 개량한 제품이다.
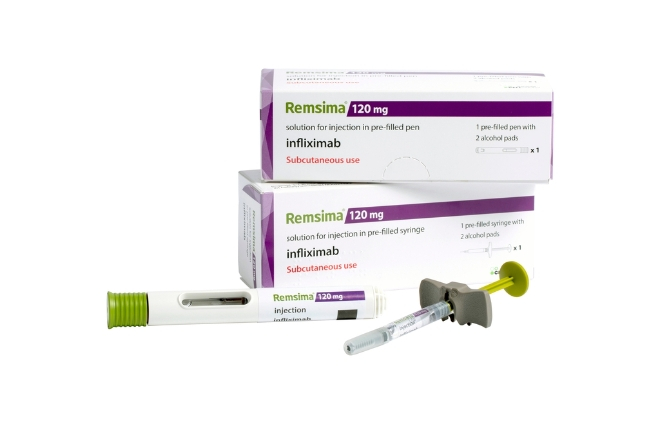
이번 임상은 총 243명을 대상으로 6주의 스크리닝 기간, 106주의치료기간으로 진행된다. 이번 임상은 중증도-중증의 활성 궤양성 대장염과 크론병 소아 환자의 유지요법으로써 램시마SC의 저용량 및 고용량 2주 간격 유지요법의 유효성 및 안전성을 평가한다.
셀트리온은 "램시마SC의 성인 환자 대상 임상 3상은 완료해 FDA에 허가 절차를 진행중"이라며 "소아 임상 3상을 통해 성인 궤양성 대장염 및 크론병 적응증과 함께 더 많은 환자에게 치료 기회를 제공할 수 있을 것으로 기대한다"고 말했다.
황성완 기자 skwsb@smartfn.co.kr
















댓글
(0)